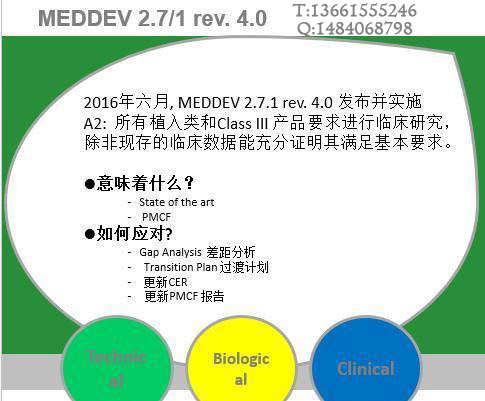
近两年,欧盟加强了临床评价和上市后监督的要求。2016年7月,医疗器械临床评估的全新指导文件MEDDEV 2.7/1第4版在欧盟委员会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的临床评价,以及如何证明数据和结论的科学有效性有了更明确的指导。这也给制造商带来了新的挑战。
该指南涉及93/42/EEC和90/385/EEC指令范围内的制造商和公告机构。
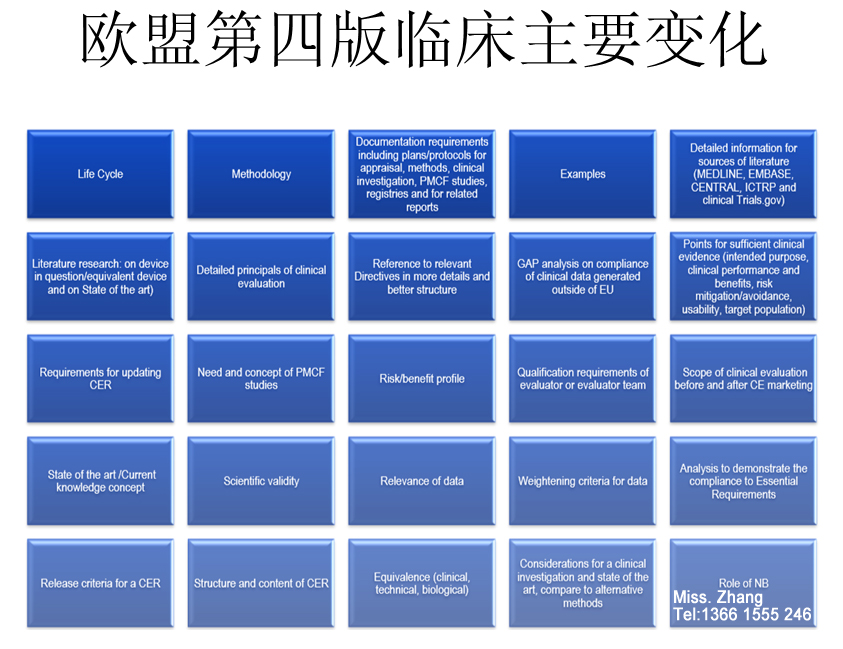
该指南包括:明确临床评估意图、对评估各步骤的详细指导、明确等同性评估的条件、指出不可用于证明符合欧洲指令的临床数据的具体案例、关于临床评估报告更新的时间安排,对于评估人员资质的最低要求、以及此前版本指南不包括的其他具体细节。
医疗器械的制造商需要针对本文件当中公布的变更内容进行评审并基于受影响的程度需要编写新的临床评估报告。
就临床评价报告的范围而言,和第三版一样,临床评价的范围应建立在需要满足的基本要求(ER)的基础之上。MEDDEV 2.7.1第四版的附录7就如何分析临床数据来证明其满足基本要求提供了许多额外的指南。
MEDDEV 2.7.1第四版的最大变化之一,就是证明“实质等同”的难度要比之前大很多。最关键的要求就是一个器械必须满足所有三个一般标准(临床、技术和生物)才能证明“实质等同”。
MEDDEV 2.7.1第四版的附录2就何时需要进行临床试验提供了指南。除可植入器械和III类器械必须进行临床试验(除非有其它正当理由)外,以下情形也需要进行临床试验:器械运用了新技术或现有技术的临床新用途;现有的临床数据存在任何差距不足以证明器械(包括I类、IIa类和IIb类器械)使用的受益、风险、要求或副作用满足适用的基本要求。
MEDDEV 2.7.1第四版还规定了公告机构的角色和职责。公告机构必须为临床评价报告的评估建立所要求的QMS程序,且必须拥有评估临床评价报告所需的专业知识,还需要对其评估的所有临床评价案例出具临床评价评估报告(CEAR)。
欧盟临床评估指南MEDDEV 2.7.1第四版已经发布和实施近两年,各个公告机构也在全面落实新版指南要求。
针对MEDDEV2.7.1 Rev 4,我司可以协助您:
1、寻找等同产品,进行等同分析;
2、搜索文献及其他临床数据;
3、临床数据分析;
4、完成临床评价报告;
5、全英文临床评估报告;
6、公告机构审核通过。